Le trasformazioni adiabatiche sono trasformazioni che avvengono senza scambi si calore con l’ambiente esterno; ciò significa che il sistema è isolato termicamente, e può essere formato, ad esempio, da un gas contenuto in un thermos.
Nelle trasformazioni adiabatiche, dunque, il calore che viene scambiato è pari a zero, e quindi, dal primo principio della termodinamica, si ha che il lavoro che compie il gas durante la trasformazione è uguale alla variazione negativa di energia interna.
$W = -∆U$
Di conseguenza, se il gas si espande adiabaticamente esso avrà una temperatura finale minore di quella iniziale, quindi la sua energia interna diminuisce, e la variazione è negativa; il lavoro che compie il gas durante la trasformazione, quindi, è un lavoro positivo.
Se, invece, si ha una compressione adiabatica del gas, attraverso un aumento della pressione, l’ambiente esterno compie un lavoro positivo sul sistema; quindi il lavoro compiuto dal gas sarà un lavoro negativo. Ciò significa che l’energia interna del gas aumenta in seguito alla trasformazione; si ha quindi anche un aumento della temperatura del gas.
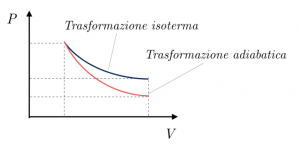
Se rappresentiamo in un grafico pressione-volume la curva di una trasformazione adiabatica, notiamo che essa assomiglia molto a quella di una trasformazione isoterma, ma scende più velocemente verso il basso:
I calori specifici di un gas perfetto
Come sappiamo, il calore specifico di un corpo può essere ottenuto come rapporto del calore che viene scambiato sul prodotto della massa per l’unità di tempo:
$ C = frac(Q)(m*∆T)$
Nel caso di un gas la quantità di calore che viene scambiata dipende dal tipo di trasformazione che esso compie.
Nel caso di una trasformazione isocora il calore è uguale alla variazione di energia interna (Q = ∆U); nel caso di una trasformazione isoterma o ciclica esso è uguale al lavoro svolto dal gas (Q = W); nel caso di una isobara si ottiene come somma dell’energia interna con il lavoro svolto (Q = ∆U + p∆V).
Nel caso di una trasformazione isocora, quindi, il lavoro svolto dal è nullo; tutto il calore che viene fornito servirà ad aumentare l’energia interna del gas, e di conseguenza la sua temperatura.
Per la trasformazione isobara, invece, il calore che viene fornito serve in parte per un aumento della temperatura, e in parte per permettere al gas di compiere lavoro.
A parità di calore, quindi, se facciamo compiere ad un gas una trasformazione isocora avremmo un aumento di temperatura maggiore rispetto ad una sua trasformazione isobara.
Una conseguenza di questo fatto è che il calore specifico di un gas a pressione costante è maggiore del calore specifico dello stesso gas a volume costante; infatti nel primo caso di ha un minore aumento di temperatura, e nella formula ∆T si trova al denominatore.
Si può dimostrare, inoltre, che il calore specifico di un gas può essere calcolato conoscendo la sua massa molare M.
In particolare, nel cado di un gas perfetto a volume costante avremo la seguente relazione:
$c_v = l/2 * R/M $
dove l indica il numero di gradi di libertà delle particelle.
Mentre, nel caso di un gas perfetto a pressione costante, il calore specifico è dato dalla seguente formula:
$c_P = frac(l+2)(2) *R/M $
Esercizio
Un gas perfetto subisce una trasformazione isocora, assorbendo una quantità di calore pari a $1,2 * 10^3 J$. Mediante tale trasformazione, il gas passa subisce una variazione di temperatura di 15°C. Sapendo che la massa del gas è di 25g, quanto vale il suo calore specifico?
Nel caso di una trasformazione a volume costante sappiamo che tutto il calore che il gas assorbe servirà ad aumentare la sua temperatura.
In questo caso, quindi, possiamo utilizzare la seguente formula per determinare il calore specifico del gas:
$c = frac(Q)(m*∆T) $
Ricordiamo che la massa di esprime in kg, quindi occorre trasformare il valore di massa che abbiamo: 25g = 0,025 kg.
Sostituiamo i valori numerici e determiniamo il calore specifico del gas;
$c = frac(1200)(0,025*15) = 3200 frac(J)(kg*K) $
Potrebbero interessarti
Appunti: La legge di Boyle e i gas perfetti
Appunti: Trasformazioni dei gas e Leggi di Gay-Lussac
